疾病等・不適合の報告
■疾病等の報告
特定臨床研究の実施に起因するものと疑われる疾病、障害若しくは死亡又は感染症の発生、不具合等を認めたときは、認定臨床研究審査委員会等へ報告・委員会による意見書が必要です。
疾病等報告の報告期限は下記のとおりです。
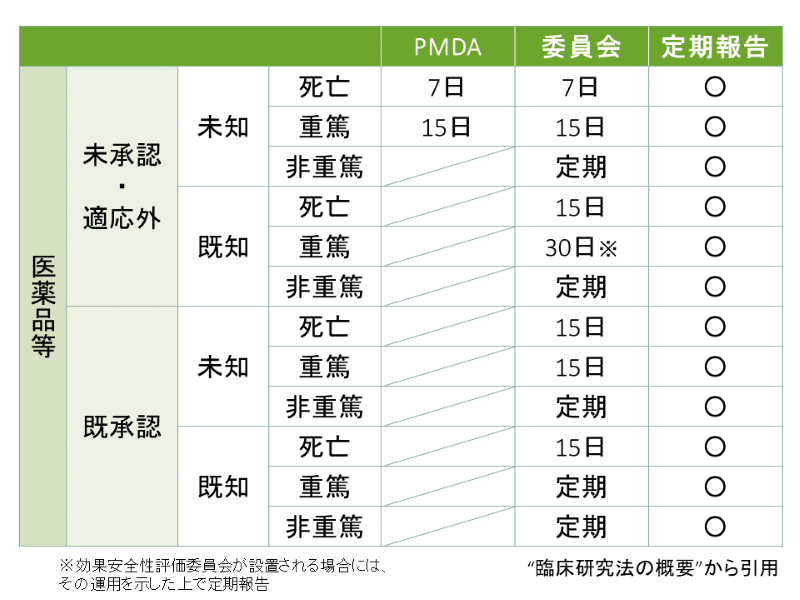

■不適合の報告
研究責任医師は、臨床研究が省令または研究計画書に適合していない状態(「不適合」という)であると確認した時には、速やかに医療実施機関の管理者に報告しなければなりません。特に重大なものが判明した場合においては、速やかに認定臨床研究審査委員会の意見を聴かなければなりません。
(多施設共同研究における研究代表医師は、速やかに他の研究責任医師に情報提供しなければなりません。)
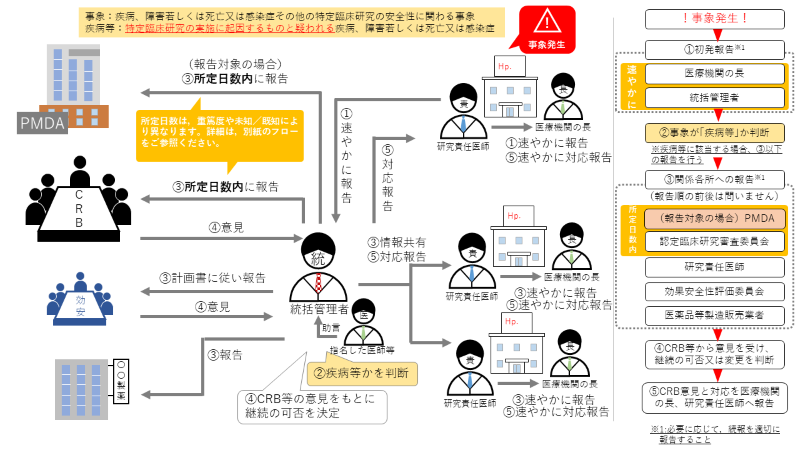
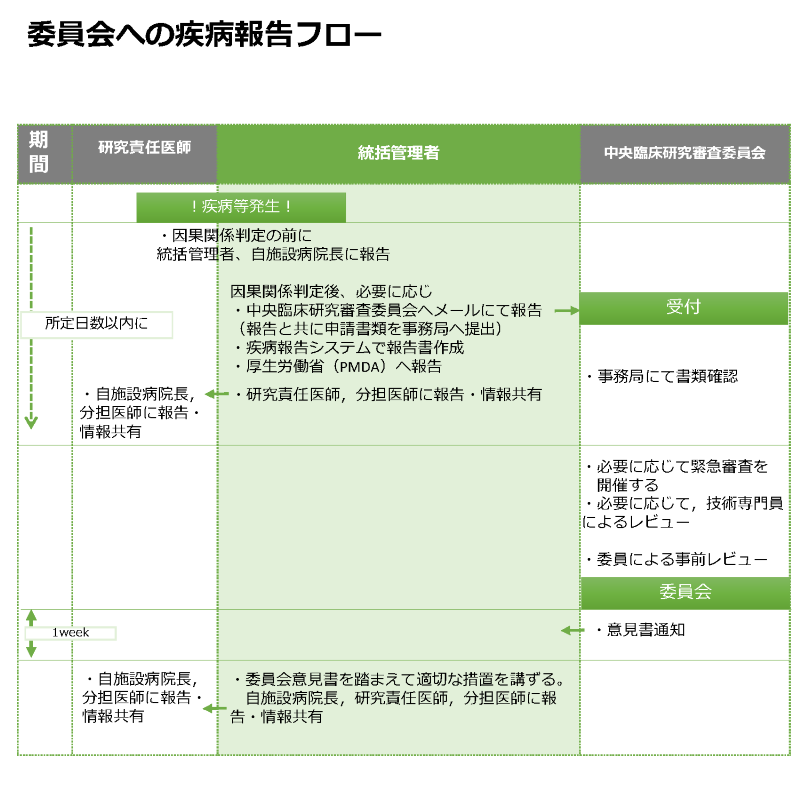
申請フロー
下図フローに準じて、ご報告ください。
※新潟大学以外では手続きが異なります。
※新潟大学医歯学総合病院における手順書等はこちら(学内専用ページ)をご参照ください。
委員会への届け出必要書類
下記書類を添付して事務局までメールでご連絡ください。
疾病等の報告
| 1. | 以下のいずれかの書類の提出が必要です。 | |
| (統一書式8) 医薬品の疾病等報告書 | <ダウンロード> | |
| (統一書式9) 医療機器の疾病等又は不具合報告書 | <ダウンロード> | |
| (統一書式10) 再生医療等製品の疾病等又は不具合報告書 | <ダウンロード> | |
| 2. | 疾病等報告書(医薬品) または 疾病等報告書(医療機器) | jRCT(臨床研究実施計画・研究概要公開システム)のアカウントにてログイン後、ページ下部の疾病等報告より、疾病等報告サービスをご利用いただけます。疾病等報告サービスで作成したPDFをご提出ください。 |
重大な不適合報告
| 1. | 重大な不適合等報告書 | <ダウンロード> |
※重大でない不適合を報告する際は委員会への報告は不要ですが、
各医療機関毎のSOP等を確認の上、所定の様式にて医療実施機関の管理者へ報告してください。
新潟大学所定の様式は こちら(病院内教職員専用サイト)から入手下さい。
