定期報告
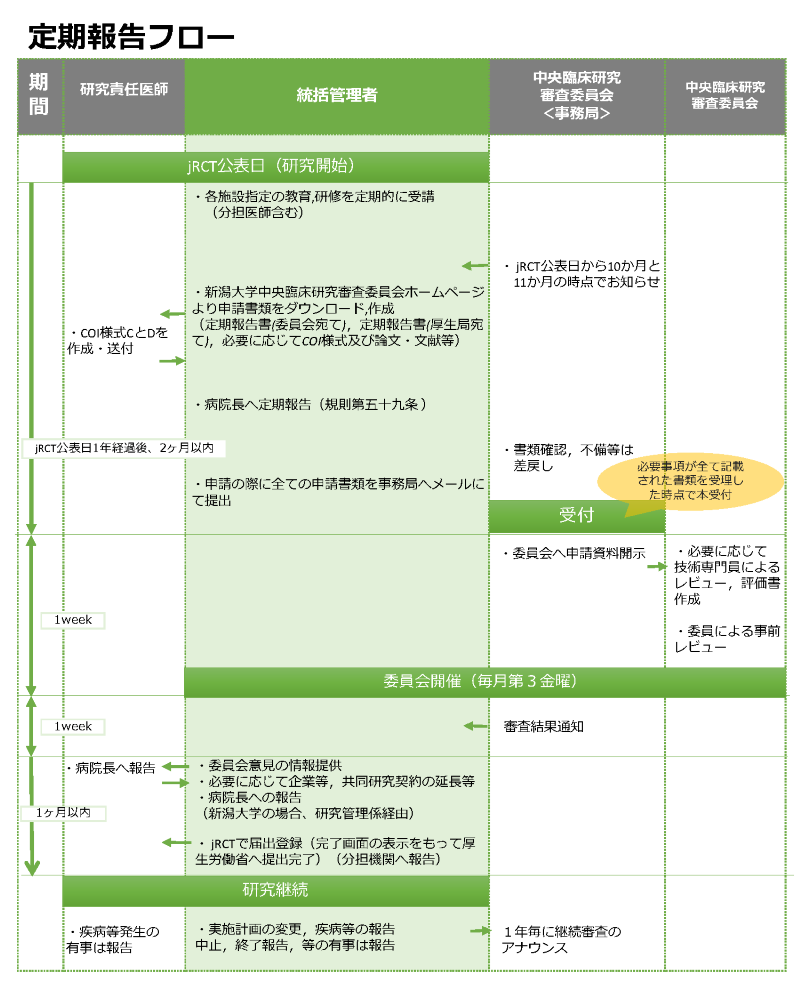
研究責任医師(多施設の場合は研究代表医師)は原則として、実施計画を厚生労働大臣に提出した日から起算して1年ごとに、当該期間満了後2月以内に特定臨床研究の実施状況について、実施医療機関の管理者に報告した上で、認定臨床研究審査委員会へ報告が必要です。
さらに認定臨床研究審査委員会が意見を述べた日から起算して1か月以内に、厚生労働大臣(CRBの所在地を管轄する地方厚生局)へ報告(定期報告書を提出)しなければなりません。(※非特定臨床研究において、厚生労働大臣への報告は不要)
申請フロー
下図フローに準じて、ご報告ください。
新潟大学の場合は、CRB事務局に提出してください。
CRB事務局→研究管理係→病院長への定期報告手続き→CRB審査に自動的に移行します。
必要提出書類
下記書類を添付して事務局までメールでご連絡ください。
| 1. | (統一書式5)定期報告書 ※記載例はこちら(学内専用ページ) |
<ダウンロード> |
| 2. | (別紙様式3)定期報告書 | jRCTにて一時登録したデータを出力したファイルを提出してください |
| 3. | 論文又は文献等 (ある場合のみ) | |
| 4. | 利益相反管理基準及び利益相反管理計画 (※定期報告の際に各利益相反申告者の寄附金等の提供の状況を確認してください。確認の結果、すでに提出しているCOI申告内容に変更がない場合は、提出を省略することができます。)
|
<ダウンロード>(193KB) |
