実施計画等の変更審査
実施計画等に変更が生じる場合・新たな資料を追加する場合は、あらかじめ認定臨床研究審査委員会での審査と厚生労働大臣(CRBの所在地を管轄する地方厚生局)への報告または通知が必要です。
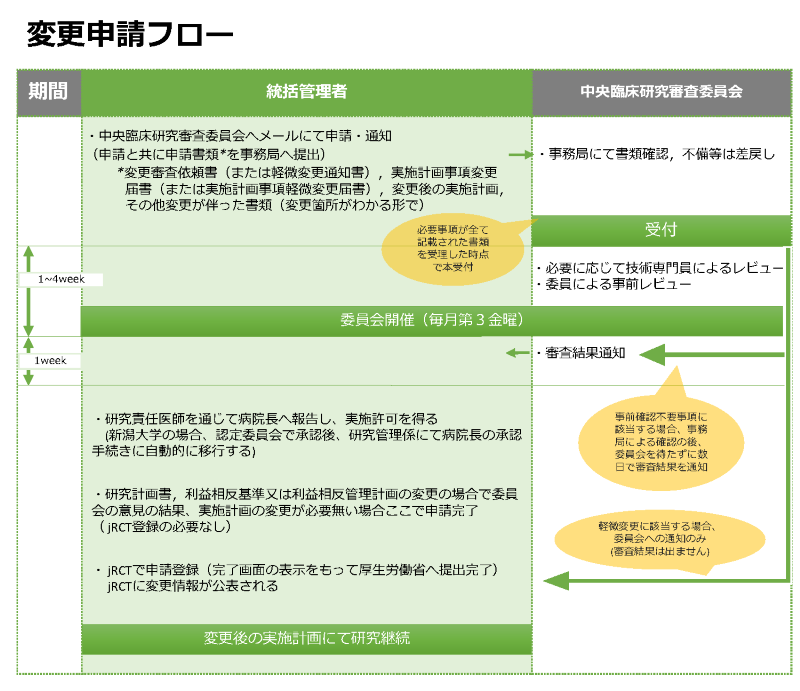
申請フロー
【変更申請を要する場合】
新規申請時に提出した書類に変更が生じたとき(実施計画、研究計画書、COI申告内容に変更が生じた際は必須)、下記3つのいずれの変更に相当するか項目を確認のうえ、それぞれに示す手順により申請または通知を行って下さい。
なお、変更点が以下のカテゴリの複数にまたがる際、jRCTの仕様により通常の変更(下記3.)と軽微な変更(下記1.)を同時に実施することが出来ませんので、委員会への申請についても区別して順に手続きをお願い致します。詳細は事務局にご相談ください。
- 軽微な変更に該当するもの
→軽微変更通知書にて委員会へ通知するとともに、jRCTにて厚生労働省へ届け出を行ってください
(通知・届け出は変更の日から十日以内)
※審査結果通知書は出ませんので、通知および届け出の完了をもって変更は有効となります。(参考)実施計画と軽微変更の範囲の対応表はこちら→リンク
① 特定臨床研究に従事する者の氏名、連絡先又は所属する機関の名称の変更(当該者又は当該者の所属する機関の変更を伴わないものに限る)
② 地域の名称の変更又は地番の変更に伴う変更
③ 苦情及び問い合わせを受け付けるための窓口の変更
④ 研究責任医師等の所属する実施医療機関の管理者の氏名の変更
⑤ 特定臨床研究の実施の可否についての管理者の承認に伴う変更
⑥ 特定臨床研究の実施状況の確認に関する事項の変更(研究の結果及び監査の実施の変更を伴わないものに限る。)
⑦ 審査意見業務を行う認定臨床研究審査の名称又は連絡先の形式変更(当該認定臨床研究審査委員会の変更を伴わないものに限る)
⑧ 特定臨床研究の実施の適否及び実施に当たって留意すべき事項に影響を与えないものとして厚生労働省医政局長が定めるもの - 事前確認不要事項の審査(事務局が確認することをもって承認したものとみなすもの)
→変更申請フローに従って申請してください。変更内容が事前確認不要事項に相当する変更のみであった場合、 2-3日程度で審査結果通知をお出しします。その後に jRCTにて厚生労働省へ届け出を行ってください。① 統計解析担当機関の担当責任者又は担当者並びにそれらの所属及び役職の変更(軽微変更に該当しない場合に限る)
② 契約締結日の追加
③ e-Rad 番号の変更
④ 審査資料の作成日付・版番号の変更(内容の変更を伴わない場合に限る)
⑤ 医薬品等の概要を記載した書類の変更(既承認薬における添付文書の改訂等に伴う場合に限る) - 上記1,2以外の変更審査
→変更申請フローに従って申請してください。 直近の委員会で審議した後、審査結果通知をお出しします。その後に jRCTにて厚生労働省へ届け出を行ってください。
※軽微な変更に該当する変更を同時に行う場合は、それぞれ個別に届を提出してください。
(例)・誤記の修正
・研究責任医師の変更、研究分担医師の変更
・実施医療機関の追加、削除
・利益相反管理基準の変更、利益相反管理計画の変更 など
必要提出書類
軽微変更の通知
下記書類を添付して事務局までメールでご連絡ください。通知は随時受け付けます。
| 1. | 軽微変更通知書 | <ダウンロード> |
変更審査
下記書類を添付して事務局までメールでご連絡ください。
委員会開催1週間前を目安に申請してください。
| 1. | 変更審査依頼書 ※記載例はこちら(学内専用ページ) |
<ダウンロード> |
| 2. | 実施計画事項変更届書 |
jRCTにて一時登録したデータを出力したファイルを提出してください。 |
| 3. | 実施計画 | jRCTにて一時登録したデータを出力したファイルを提出してください |
| 4. | その他内容に変更が生じた書類 | 変更箇所が分かる形で提出してください。 |
